Embora muitos aminnoácidos sejam conhecidos, apenas 20 polimerizam para formar cadéias protéicas. São ditos monômeros das proteínas, formados fundamentalmente por um carbono central alpha (α) ligado a um grupo amina (NH³) positivamente carregado, e um grupo carboxila (COO) negativamente carregado além de um Hidrogênio e um radical que determina cada aminoácido.
Disponível em <3.ggpht.com/-hJ6v4lltcvY/ThiPYlvkG9I/AAAAAAAAC0Y/PLjX72DpajQ/ESTRUTURA%252520AMINO%2525C3%252581CIDO%252520BIOMEDICINA%25255B4%25255D.png?imgmax=800>
Tanto o grupo carboxílico qaunto o grupo amino garantem ao aminoácido um caráter anfótero, ou seja, dependendo do pH do meio permite que ele se comporte como ácido doando protóns, ou como base recebendo protóns.
Já sabemos que o grupo carboxílico e o grupo amino possuem carga, entretanto caso não estejam carregados geram soluções neutras zwiterions, sem nenhuma carga líquida. Isso ocorre por que ambas as cargas se anulam.
⇒Curva de titulação:
Uma solução alcalina de aminoácido, em meio ácido, indica a reação de cada grupo funcional com o íon Hidrogênio. Tomemos a Alanina como exemplo, se partirmos de pH extremamente ácido, aproximadamente 1, e formos adicionando gradativamente pequenas quantidades de NaOH e plotarmos o pH da solução em função do número de equivalente de OH- adicionados, obteremos uma curva com três regiões definidas: AB, BC e CD.
Os principais pontos de um gráfico de curva de titulação são: PKa PKi e PKb.
PKa é o ponto em que metade das moléculas do ácido se encontram com carga positiva em equilíbrio com sua outra metade, zwiteriônica.
PKi é o oponto isoéletrico onde o pH é aproximadamente 6,02 quando o aminoácido encontra-se totalmente em sua forma zwiteriônica (sem o protón da carboxila).Isso implica que a soma de suas cargas resultará em zero, logo o mesmo não se movimenta ao ser colocado em uma diferença de potencial. Para encontrar o PKi de uma solução podemos adotar a seguinte fórmula:
PKb é o ponto em que metade dos aminoácidos encontrem-se em sua forma zwiteriônica e a outra metade possua carga negativa.
A titulação é finalizada quando o aminoácido encontra-se totalmente sem protóns.
Monografia:
Informações extraídas de <ambientenet.eng.br/AULAS/AULA%2002.pdf> Acesso em 24 de março de 2017.
MASTROENE, Marcos e GERN, Regina. "Bioquímica práticas adaptadas". Biblioteca biomédica- Belo Horizonte,2008.
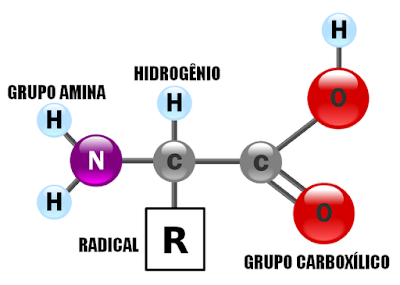 | |||||||
| Fig.1 O QUE CARACTERIZA UM AMINOÁCIDO É O SEU RADICAL |
Dentre os 20 aminoácidos, 19 apresentam quatro ligantes diferentes caracterizando o carbono α como carbono quiral, o que lhe atribui propriedades ópticas.
Para entendermos a definição de carbono quiral é preciso pensar na isoméria de uma molécula, isto é sua organização no espaço. Não se pode, por exemplo, pegar uma luva da mão esquerda e calça-la na mão direita. Ou seja a forma como os átomos estão arranjados num composto aminoácido também é um fator característico da molécula.
 |
| Fig.2 Mãos assimetricas. Disponível em< alunosonline.uol.com.br/upload/conteudo/images/maos-assimetricas.jpg> |
Esta propriedade dá a esses 19 aminoácidos a possibilidade de existirem em duas formas isoméricas levógero(L) ou dextrógero (D). Segundo a convenção de Fisher estas moléculas desviam luz polarizada para a esquerda e para a direita respectivamente.
Já o nosso vigéssimo aminoácido- não possui carbono quiral- é a Glicina (GLY) ela é classificada dessa forma por que seu radical é composto exclusivamente por um Hidrogênio.
⇒CLASSIFICAÇÃO:
Há diferentes formas de classificar-mos os aminoácidos e uma das mais usuais diz respeito àos radicais dessas moléculas que os dividem em quatro grandes grupos:
- Aa apolares;
- Aa polares não carregados;
- Aa polares negativamente carregados;
- Aa polares positivamente carregados;
Tanto o grupo carboxílico qaunto o grupo amino garantem ao aminoácido um caráter anfótero, ou seja, dependendo do pH do meio permite que ele se comporte como ácido doando protóns, ou como base recebendo protóns.
Já sabemos que o grupo carboxílico e o grupo amino possuem carga, entretanto caso não estejam carregados geram soluções neutras zwiterions, sem nenhuma carga líquida. Isso ocorre por que ambas as cargas se anulam.
⇒Curva de titulação:
Uma solução alcalina de aminoácido, em meio ácido, indica a reação de cada grupo funcional com o íon Hidrogênio. Tomemos a Alanina como exemplo, se partirmos de pH extremamente ácido, aproximadamente 1, e formos adicionando gradativamente pequenas quantidades de NaOH e plotarmos o pH da solução em função do número de equivalente de OH- adicionados, obteremos uma curva com três regiões definidas: AB, BC e CD.
Os principais pontos de um gráfico de curva de titulação são: PKa PKi e PKb.
PKa é o ponto em que metade das moléculas do ácido se encontram com carga positiva em equilíbrio com sua outra metade, zwiteriônica.
PKi é o oponto isoéletrico onde o pH é aproximadamente 6,02 quando o aminoácido encontra-se totalmente em sua forma zwiteriônica (sem o protón da carboxila).Isso implica que a soma de suas cargas resultará em zero, logo o mesmo não se movimenta ao ser colocado em uma diferença de potencial. Para encontrar o PKi de uma solução podemos adotar a seguinte fórmula:
Pki=(PKa+PKb)/2
PKb é o ponto em que metade dos aminoácidos encontrem-se em sua forma zwiteriônica e a outra metade possua carga negativa.
A titulação é finalizada quando o aminoácido encontra-se totalmente sem protóns.
Monografia:
Informações extraídas de <ambientenet.eng.br/AULAS/AULA%2002.pdf> Acesso em 24 de março de 2017.
MASTROENE, Marcos e GERN, Regina. "Bioquímica práticas adaptadas". Biblioteca biomédica- Belo Horizonte,2008.
Comentários
Postar um comentário